
RÉSUMÉ
Notre objectif était d’évaluer l’efficacité du système d’automatisation totale du laboratoire DxA 5000 avec REMISOL Advance de Beckman Coulter (DxA 5000) en termes de délai d’exécution (TAT) au laboratoire et de manipulation manuelle des échantillons.
Grâce à la collecte de données sur des indicateurs spécifiques dans le processus analytique du laboratoire, nous avons comparé et analysé les délais d’exécution avant et après l’installation du DxA 5000. Nous avons également comparé le taux d’erreurs pré-analytiques et le délai de traitement du dernier échantillon de la journée dans cette étude. Cela permet de mieux comprendre l’efficacité et la productivité du nouveau système automatique.
Nos résultats montrent que la nouvelle solution DxA 5000 garantit des délais d’exécution rapides et constants, ainsi qu’un nouveau niveau de qualification préanalytique des échantillons et la réduction du nombre d’étapes de traitement manuelles, permettant ainsi d’améliorer considérablement la productivité du laboratoire.
Article également disponible en anglais, allemand, espagnol et italien.
INTRODUCTION
Les tests sanguins de diagnostic sont les procédés cliniques les plus couramment pratiqués dans le monde et ont un impact sur la plupart des évaluations médicales effectuées dans les cliniques et les laboratoires.1 Depuis le milieu des années 1970, l’automatisation des laboratoires est la pierre angulaire de nombreux services de laboratoire clinique et, au fil du temps, ce domaine a connu des transformations technologiques majeures.2 Le développement de systèmes d’automatisation de laboratoire flexibles a attiré une attention considérable ces dernières années, alors que les scientifiques en biotechnologie effectuent des types de protocoles plus variés dans le milieu hospitalier ; et se tournent vers l’accélération du processus analytique tout en maintenant la qualité et la précision des résultats.3
Ce qui caractérise l’« Automatisation Totale de Laboratoire » (TLA) est la capacité d’intégrer toutes les étapes du traitement des échantillons, de la phase pré-analytique à la phase post-analytque avec une robotique et des logiciels sophistiqués.2 La dernière consolidation d’analyseurs issus de plusieurs disciplines sur un seul système est en mesure de fournir une efficacité à plus grande échelle, avec des avantages qui vont au-delà des services de laboratoire : l’amélioration de la qualité et de la précision des résultats des tests ; ainsi que l’offre d’un service clinique plus efficace.
Il est bien connu que l’Assurance Qualité (AQ) et le Contrôle de Qualité (CQ) jouent un rôle important pour assurer la conformité aux Bonnes Pratiques de Fabrication (BPF) actuelles, en préservant la cohérence et la qualité des résultats des tests.4 Mais, un autre aspect important de la qualité des laboratoires cliniques est la rapidité, qui est exprimée en délai d’exécution (TAT).5 Actuellement, le terme « TAT thérapeutique » est utilisé pour décrire le délai entre le moment où un test est prescrit et le moment où une décision de traitement est prise.6,7 Les services de laboratoire visent à apporter un compte rendu rapide, fiable et précis aux cliniciens en se basant sur des systèmes de communication efficaces et un délai d’exécution rapide pour le rendu des résultats des tests. Ceci dans le but de raccourcir le temps « de la veine au cerveau » pour que le traitement du patient ne soit pas retardé. En tant que tel, le TAT est désormais l’un des insignes le plus visible du service de laboratoire et est souvent utilisé comme indicateur de performance clé (KPI) de la performance du laboratoire.7
Dans le contexte réel du laboratoire, la définition du TAT est généralement limitée aux activités intra-laboratoire, qui séparent les étapes de manipulation des échantillons en différentes phases du processus analytique :
1. pré-analytique (de la prescription à la préparation)
2. analytique
3. post-analytique (du résultat à l’action)8
Dans chaque phase, il existe des points critiques pour l’analyse du délai d’exécution qui peuvent être utilisés pour examiner l’efficacité des systèmes TLA. Ceci, associé à un certain nombre d’exigences nécessaires pour comparer les données collectées, peut servir de cadre à une étude uniforme sur l’efficacité d’un TLA.
Notre objectif à travers cette étude était de démontrer, grâce à des indicateurs pour l’analyse de routine d’un laboratoire central, l’efficacité de la nouvelle solution TLA DxA 5000 de Beckman Coulter en termes de réduction du délai d’exécution du laboratoire et de la manipulation manuelle des échantillons pendant les heures de pointe des laboratoires cliniques.
MÉTHODES
Exigences pour la collecte de données comparables
Afin de pouvoir comparer les données collectées de manière appropriée, un ensemble de normes a été défini par l’équipe de recherche, fournissant des modèles pour l’enregistrement des données dans la mesure du possible. Les points de départ et d’arrivée des mesures ainsi que la source de données au sein du même processus ont été décrits. Les tubes d’échantillons de Blood Science choisis pour l’analyse étaient : STAT (urgence), citrate et tests sériques de routine. D’autres précisions ont été apportées notamment sur le fait que les enquêtes étaient manuelles ou automatiques.
Afin d’évaluer le TAT pendant la période la plus chargée du laboratoire, les délais d’exécution ont tous été collectés en une journée pendant les heures de pointe de 12h30 à 16h30. Ainsi, les données de TAT ont été collectées le 02/07/2019 dans les conditions avant installation ; et le 07/10/2020 dans les conditions après installation. L’analyse a été faite avec des valeurs médianes calculées à partir de données brutes.
Mesures de TAT avant installation du DxA 5000 (processus de manipulation manuelle)
Étant donné que les échantillons sont amenés au laboratoire par le livreur en séries importantes, une fois arrivés au laboratoire, une heure d’arrivée identique a été attribuée à tous les échantillons de la même série (heure d’arrivée du livreur).
Dans le cas du protocole d’étude AVANT installation, des échantillons prélevés manuellement et de manière aléatoire ont été identifiés à l’arrivée au laboratoire et ont été suivis jusqu’à la fin du processus analytique. La mesure a commencé à chaque fois lorsqu’un livreur est entré dans le laboratoire avec sa tournée. Les chercheurs ont suivi manuellement les échantillons prélevés au hasard jusqu’à la mesure d’entrée de la première plate-forme d’automatisation. Ensuite, les chercheurs ont collecté des horodatages à partir de plusieurs sources (AutoMate (trieur autonome d’échantillons), plates-formes analytiques, système de gestion des données), qui indiquent chacune les étapes suivantes du processus. Ces horodatages ont ensuite été associés pour évaluer la durée totale depuis l’entrée de l’échantillon dans le laboratoire jusqu’à ce que les résultats soient disponibles pour une utilisation clinique.
Mesures de TAT après installation du DxA 5000
Dans le protocole d’étude après installation, des échantillons prélevés manuellement et de manière aléatoire ont été identifiés à l’arrivée au laboratoire et ont été suivis manuellement jusqu’à ce qu’ils soient introduits dans le système DxA 5000. A partir de ce moment, les échantillons ont été suivis jusqu’à la fin du processus analytique par REMISOL Advance, le logiciel de gestion des données inclus avec le DxA 5000. Comme décrit précédemment, tous les échantillons arrivant dans la même série ont reçu une heure d’arrivée identique (heure d’entrée du livreur) et l’heure finale à la fin de l’analyse a été enregistrée et utilisée pour l’évaluation du TAT.
Détection d’erreur
Les données de détection d’erreur ont été collectées sur une seule journée dans les conditions avant et après installation. Les types de tubes erronés, volumes d’échantillon insuffisants, index sériques via des analyseurs connectés ou erreurs de code-barres ont été suivis manuellement dans les conditions avant installation ; et, automatiquement par le logiciel REMISOL Advance de DxA 5000, dans les conditions après installation.
Analyse de données de la dernière livraison
Afin d’évaluer la productivité des opérateurs et des systèmes dans les conditions avant et après installation, l’heure de la dernière livraison de la journée a été enregistrée, puis le temps écoulé pour terminer le traitement du dernier tube d’échantillon de la journée dans les deux conditions a été relevé. Les données ont été collectées de mars à mai 2019 pour les conditions avant installation ; et à partir de juillet-septembre 2020, pour les conditions après installation.
RÉSULTATS
DxA 5000 réduit le délai d’exécution (TAT) total pour plusieurs types d’échantillons reçus par un laboratoire Blood Sciences type
Le TAT a été analysé et comparé avant et après l’installation du nouveau TLA, DxA 5000. Comme décrit dans le chapitre méthodes, le TAT a été calculé manuellement ou automatiquement dès l’arrivée des échantillons au laboratoire jusqu’à ce que le résultat soit prêt pour une utilisation clinique (TAT total). Comme le montre la Figure 1, pendant les heures de pointe du laboratoire, il y a une réduction significative du TAT total lors de la manipulation de différents types des échantillons sélectionnés (STAT, tests sérique de routine et citrate). Ainsi, après l’installation du DxA 5000, il y a une réduction de 61 % du TAT total pour les échantillons d’urgence (STAT), une réduction de 12 % du TAT total pour les tests sériques de routine et une réduction de 53 % du TAT total pour les tubes de citrate.
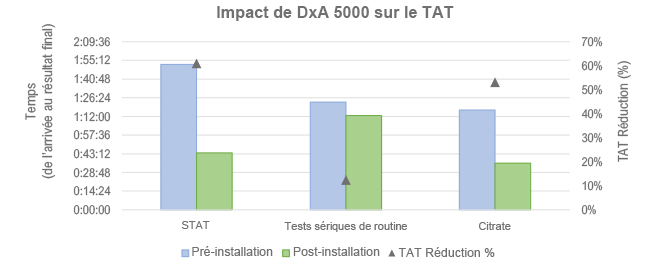
Figure 1 — Axe gauche : Comparaison du temps écoulé entre l’arrivée et la disponibilité du résultat final pour différents échantillons de laboratoire (STAT, tests sériques de routine et citrate) dans les conditions avant et après installation du DxA 5000. Axe droit Analyse de l’impact sur le pourcentage de réduction du délai d’exécution (TAT) total avant et après l’installation du DxA 5000.
Nous avons défini le délai d’exécution contrôlé par le laboratoire pour les échantillons les plus sensibles au facteur temps, depuis le moment de leur arrivée au laboratoire jusqu’à la publication des résultats dans le dossier médical électronique aux heures de pointe du laboratoire. En utilisant ce critère, nos données ont démontré qu’il existe une réduction significative du temps de traitement des échantillons après l’installation du DxA 5000. Étant donné que le TAT reflète la fonctionnalité et l’efficacité d’un service de laboratoire, ces résultats démontrent qu’avec le DxA 5000 automatisé, le processus analytique du laboratoire devient plus efficace fournissant des résultats cliniques plus rapidement. Étant donné que les décisions cliniques dépendent de la communication rapide des résultats du laboratoire, la rapidité du DxA 5000 TLA automatisé accélère les décisions cliniques, ce qui à son tour affecte les résultats cliniques et, par conséquent, sauve des vies.
DxA 5000 améliore la qualité et l’efficacité des tests de diagnostic en laboratoire
Comme le montre la Figure 2, une fois les échantillons reçus par le laboratoire, l’automatisation de l’identification des erreurs pré-analytiques a entraîné une augmentation du tri des échantillons défectueux. Que ce soit pour l’identification de types de tubes erronés, pour un volume d’échantillon insuffisant ou pour des erreurs de code-barres via DxA 5000, ou pour des index sériques via des analyseurs connectés, le système automatisé DxA 5000 a pu identifier davantage d’échantillons défectueux par rapport à un système de manipulation manuelle. La définition de règles de validation basées sur des critères prédéfinis avec le logiciel REMISOL Advance a permis l’auto-vérification des données, l’analyse répétée automatique des échantillons présentant des résultats très anormaux ou suspects, ainsi que le déclenchement de tests réflexes (réfléchissants) et complémentaires, contribuant ainsi au final à une qualité et une sécurité améliorées des tests de diagnostic.

Figure 2 — Comparaison de l’identification des erreurs pré-analytiques dans de différents types d’échantillons avant installation (à gauche) et après installation (à droite) du DxA 5000
De plus, avec le DxA 5000 automatisé, les échantillons ont été automatiquement archivés et disponibles pour une analyse plus approfondie à la fin de la série. Ceci a entraîné une diminution de la manipulation manuelle des échantillons, ce qui améliore encore l’efficacité du processus analytique du laboratoire. De même, grâce à des innovations brevetées dans le routage intelligent des échantillons, la solution DxA 5000 a permis une meilleure gestion des échantillons, permettant ainsi la vérification automatique des données, l’analyse répétée automatique des échantillons présentant des résultats hautement anormaux ou suspects, sans avoir besoin d’attendre pour traiter de nouveau tous échantillons en une seule série. De plus, la traçabilité des échantillons est constamment améliorée en maintenant tous les échantillons de routine et STAT dans un environnement unique, permettant la traçabilité numérique de tous les processus auxquels un tube a été soumis, de la livraison au laboratoire jusqu’au stockage une fois les tests terminés.9 Cela contribue efficacement à l’amélioration de la qualité et de l’efficacité des tests de diagnostic en laboratoire.
Le dernier tube de la journée est analysé plus rapidement avec le DxA 5000
Comme le montre la Figure 3, au cours de la période d’analyse de trois mois, la manipulation manuelle du dernier échantillon de la journée prenait environ 1 h et 20 min (avant installation). Après l’installation du DxA 5000, le dernier tube de la journée a toujours été analysé en moins de 60 min, conduisant à une diminution effective du temps nécessaire pour délivrer un résultat clinique à la fin de la journée de travail. Durant le premier mois, il y a une baisse de 20 % du temps requis pour l’analyse, une baisse de 61 % le mois suivant et de 38 % pour terminer l’analyse du dernier tube de la journée après l’installation du DxA 5000.
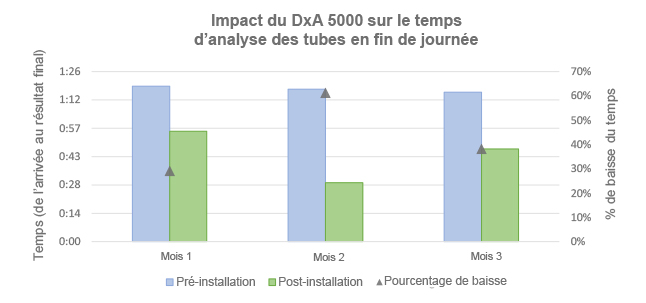
Figure 3 — Axe gauche : Comparaison du temps écoulé entre l’arrivée et la disponibilité du résultat final pour le dernier tube de la journée dans les conditions avant et après installation du DxA 5000. Axe droit Analyse du pourcentage de baisse du temps nécessaire pour terminer l’analyse du dernier tube de la journée après installation du DxA 5000.
Avec le nouveau DxA 5000, le dernier lot de la journée est analysé plus rapidement qu’en manipulation manuelle. Ce fait conduit à une baisse de la charge de travail du personnel, augmentant ainsi son moral et améliorant sa productivité. Dans la perspective actuelle de la sensibilisation à la santé mentale, des moyens efficaces de promouvoir un meilleur équilibre travail-vie conduiront à un engagement et un enthousiasme accrus de la part des employés.10
DISCUSSION
À la frontière de la technologie du diagnostic clinique, il est clair que l’intégration et l’automatisation des systèmes sont essentielles pour permettre un service de laboratoire rapide, fiable et précis. Le concept de TLA est l’assemblage de nombreux analyseurs qui effectuent de différents types de tests sur diverses matrices d’échantillons, physiquement intégrés sous forme de systèmes modulaires ou connectés par des chaînes d’assemblage. La possibilité d’assembler plusieurs disciplines spécialisées de diagnostic sur un seul convoyeur vise à améliorer l’efficacité, l’organisation, la normalisation, la qualité et la sécurité des tests de laboratoire, tout en offrant un retour sur investissement significatif à long terme et en permettant la réduction ou la requalification du personnel9. Ainsi, les systèmes TLA se sont développés à l’échelle mondiale en raison de la reconnaissance croissante de leur valeur dans l’amélioration de l’efficacité des services de laboratoire. Le nouveau DxA 5000 réduit le TAT total du laboratoire nécessaire pour l’analyse des échantillons et améliore encore le contrôle de la qualité. Avec ce nouveau système automatisé, les employés peuvent désormais être redirigés vers des activités à valeur ajoutée telles que l’assurance qualité, permettant ainsi de redéfinir et requalifier leurs rôles avec des compétences accrues. Le DxA 5000 réduit également la saturation du personnel nécessaire dans le laboratoire, évitant aux techniciens de se déplacer d’un analyseur à l’autre, minimisant ainsi la distance parcourue par le personnel pour effectuer plusieurs analyses sur différents instruments et diminuant les risques liés à la manipulation de matières à risque biologique. De plus, il réduit le temps d’analyse de la dernière livraison de la journée, effectuant cette tâche plus rapidement qu’en manipulation manuelle. Cela réduit finalement la charge de travail des employés, améliorant ainsi l’équilibre travail-vie personnelle tout en maintenant la productivité. Notre étude présente bien sûr certaines contraintes, car il serait intéressant d’évaluer d’où spécifiquement provient le temps gagné dans le processus analytique du laboratoire. Par exemple, dans la phase pré-analytique qui comprend une manipulation accrue des échantillons, de nombreuses erreurs importantes peuvent être commises en raison d’un étiquetage manuel erroné ou d’autres erreurs d’inattention. Étant donné que ces erreurs se produisent en amont du processus analytique, ces erreurs suivent souvent la feuille de route du laboratoire, compromettant ainsi le processus ultérieur et exigeant des réexécutions qui pourraient en réalité être évitées. A ce titre, la phase pré-analytique doit inclure des mesures de contrôle rigoureuses dans les services de réception/enregistrement pour éviter que des problèmes ou des erreurs se propagent par inadvertance dans le processus analytique « en aval ». Dans cet esprit, nous espérons réaliser une nouvelle étude pour évaluer le TAT par phase de processus de laboratoire (pré-analytique, analytique et post-analytique) en utilisant les mêmes conditions avant et après installation. Cette nouvelle étude pourrait révéler d’autres améliorations dans la phase pré-analytique, par exemple, que nous n’avons pas été en mesure d’évaluer à ce stade. De plus, il serait important d’évaluer statistiquement les différences observées, mais comme nous avions beaucoup plus de résultats d’échantillons automatisés que manuels, nous avons considéré qu’il serait trompeur de comparer différentes tailles de groupes. A ce titre, nous espérons publier prochainement une nouvelle étude mise à jour avec des résultats plus précis en termes de différences observées entre les conditions en manipulation manuelle et les conditions avec le DxA 5000 automatisé avec REMISOL Advance.
CONCLUSIONS
Il existe une nouvelle façon de gérer les charges de travail croissantes, de réduire les erreurs, d’améliorer les performances du laboratoire et d’améliorer le service clinique avec le nouveau DxA 5000 automatisé muni du REMISOL Advance. Les données recueillies dans notre étude indiquent qu’une nouvelle norme de délai d’exécution total et de contrôle de la qualité des échantillons peut être atteinte dans le laboratoire clinique avec ce nouveau système TLA.
Article également disponible en anglais, allemand, espagnol et italien.
 français
français

